Il cancro orale rappresenta una sfida significativa nel campo della salute pubblica e della medicina. Nei Paesi occidentali costituisce dal 6% al 10% di tutti i tumori maligni, con un'incidenza particolarmente elevata in Italia dove rappresenta circa il 6% delle patologie maligne, più frequente nei maschi rispetto alle femmine. Il 90% dei cancri della bocca sono carcinomi squamocellulari (OSCC, oral squamous cell carcinoma) e la maggior parte dei casi si verifica in soggetti di età superiore ai 40 anni, con un'età media alla diagnosi di circa 60 anni (Figura 1).
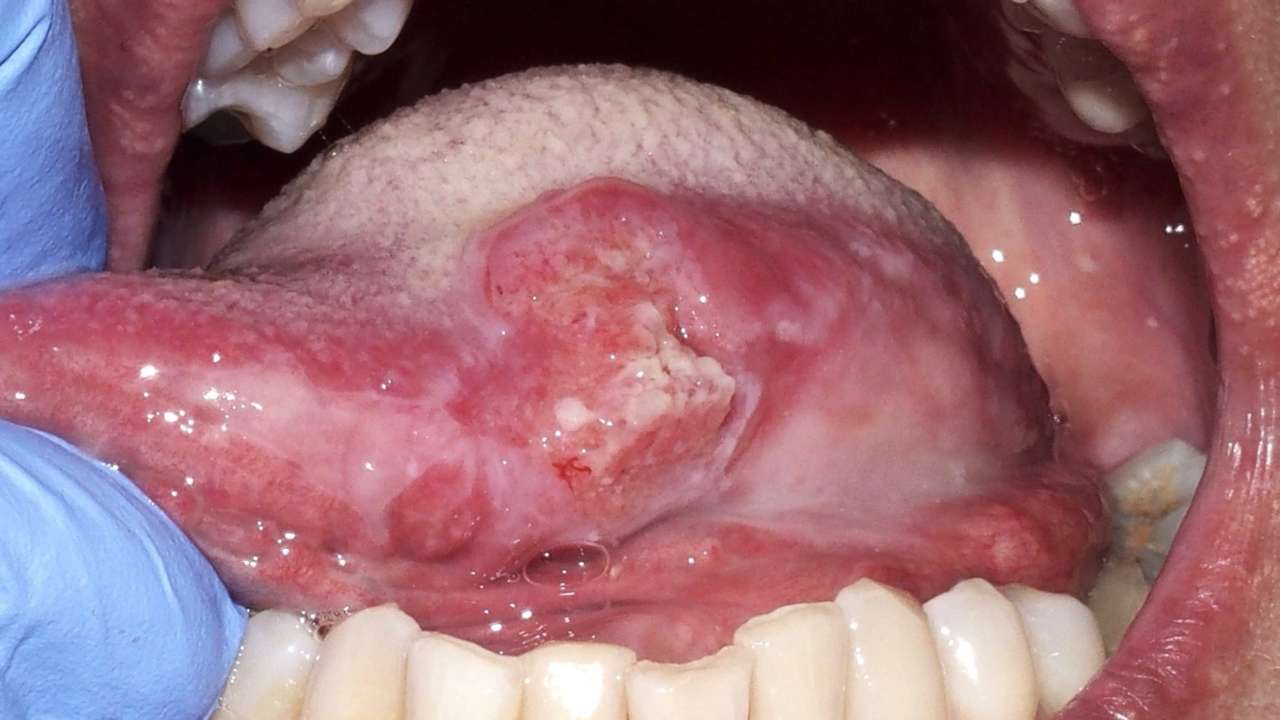
Fattori di rischio significativi per il cancro orale includono: l'uso di tabacco, il consumo di alcolici e l'associazione tra questi due fattori, che insieme costituiscono un rischio maggiore rispetto ai singoli fattori isolati. Altri fattori di rischio rilevanti sono le infezioni virali come l'HPV, la scarsa igiene orale, condizioni dentali scadenti, traumi cronici alle mucose e una dieta scorretta.
Nonostante i progressi nelle strategie terapeutiche combinate (chirurgia, chemioterapia, radioterapia), la sopravvivenza complessiva dei pazienti affetti da cancro orale è rimasta attorno al 50% negli ultimi anni, e non si è osservato un miglioramento significativo dello stadio della malattia riscontrata al momento della diagnosi.
L'importanza della diagnosi precoce
La diagnosi precoce è fondamentale per migliorare la sopravvivenza dei pazienti e ridurre la morbilità conseguente alla malattia e alle cure. Al momento della diagnosi, meno del 40% dei pazienti ha malattia localizzata, mentre nei restanti casi la malattia è già invasiva e diffusa ai linfonodi regionali o a distanza, con tassi di sopravvivenza a cinque anni significativamente più elevati nei casi di malattia localizzata.
La rapidità e la precisione diagnostica, grazie all'avanzamento tecnologico, sono diventate cruciali per ottenere una prognosi favorevole e gestire sfide terapeutiche sempre più complesse. Questo aspetto è particolarmente rilevante nel caso del cancro orale, dove una diagnosi precoce può significare cure meno aggressive e una maggiore probabilità di sopravvivenza per il paziente.
Infatti, la letteratura concorda sull'importanza dello stadio clinico e patologico al momento della diagnosi come indicatore prognostico chiave del carcinoma squamocellulare orale. Studi recenti mostrano come il tasso di sopravvivenza a 5 anni per lesioni di stadio I giunga fino al 90%, mentre per lesioni di stadio IV, la sopravvivenza scende sotto il 5%.
L'esame clinico completo del cavo orale rimane la procedura fondamentale per l'individuazione delle lesioni della mucosa orale che potrebbero rappresentare una malattia pretumorale o già un tumore maligno della bocca. Per aiutare il clinico nell'esame dei tessuti orali, sono stati sviluppati e introdotti sul mercato alcune tecniche e dispositivi che possono semplificare il riconoscimento di aree di lesione della mucosa. L'evoluzione degli ausili ottici nella diagnosi delle patologie delle mucose orali segna un capitolo fondamentale nella moderna medicina orale.
In presenza di lesioni sospette che non guariscono entro 14/21 giorni, la biopsia chirurgica con l'esame istopatologico del tessuto asportato rimangono tuttavia il gold standard per la diagnosi di patologie maligne e premaligne delle mucose orali.
I metodi che aiutano la discriminazione visuale della mucosa orale risultano utili anche per guidare la selezione dell'area della lesione su cui effettuare la biopsia.
L'obiettivo di questa breve revisione è descrivere le tecnologie disponibili per migliorare l'individuazione precoce delle affezioni e patologie orali, evidenziandone l'utilità per l'anticipazione della diagnosi di cancro della bocca. Combinando metodi ottici avanzati all'analisi di biomarcatori, si ottiene un approccio diagnostico più completo e sensibile, elevando la consapevolezza e la preparazione nella pratica clinica specialistica per il rilevamento precoce del cancro orale. Questo è fondamentale per aumentare la sopravvivenza, ridurre la morbilità e consentire trattamenti meno invasivi per i pazienti e che abbiano un minore impatto sulla qualità della loro vita.
Ausili ottici per l'esame clinico delle mucose orali
A partire dagli anni '50 del secolo scorso sono stati sviluppati, introdotti sul mercato e studiati per la loro efficacia nell'impiego clinico diversi dispositivi e tecniche per migliorare e facilitare la discriminazione visuale delle aree di mucosa orale anormali o con lesioni sospette durante l'esame clinico convenzionale del cavo orale.
Gli ausili ottici affiancano l'esame orale convenzionale (COE) e vengono utilizzati per favorire l'individuazione precoce delle aree della mucosa orale con lesioni premaligne come la displasia epiteliale e maligne come il carcinoma. Gli ausili ottici che vengono qui descritti sono la colorazione con blu di toluidina, la lumenoscopia a riflettenza, l'imaging a banda stretta (NBI) e l'autofluorescenza tissutale (OFI), che sfruttano le differenze nelle proprietà ottiche tra l'epitelio normale e quello trasformato, consentendo il miglioramento della discriminazione tra tessuto normale e alterato in modo rapido e non invasivo.
Blu di Toluidina
Sono state proposte tecniche di colorazione superficiale in vivo della mucosa orale con coloranti vitali come blu di toluidina, blu di metilene, soluzione di Lugol o fluorescina.
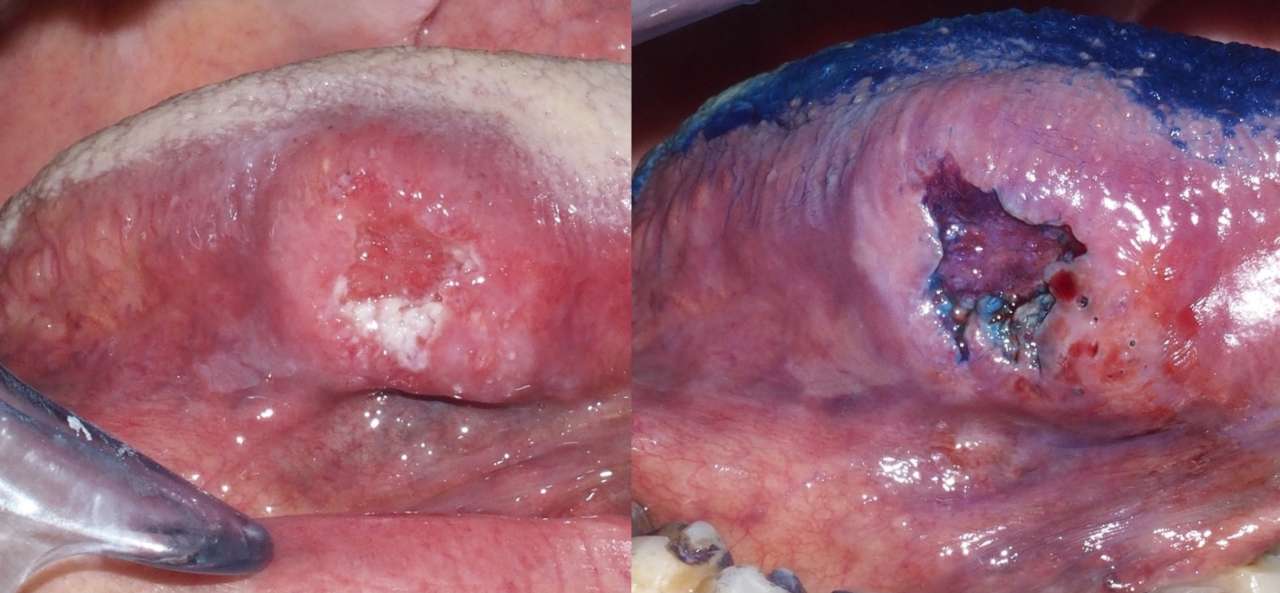
Il Blu di Toluidina (colorazione di Mashberg, BT test®), noto anche come cloruro di tolonio, è un colorante metacromatico acidofilo che si lega selettivamente ai componenti acidi dei tessuti, come solfati, carbossilati e radicali fosfato. Questo colorante ha un'affinità particolare per gli acidi nucleici e si lega quindi al materiale nucleare dei tessuti con alto contenuto di DNA e RNA.
Negli anni '60, è stata introdotta la tecnica di impiego del Blu di Toluidina come metodo per la colorazione in vivo dell'epitelio maligno delle mucose, mentre i tessuti normali non trattengono il colorante, quindi le differenze tra cellule e tessuti normali e maligni. Il colorante può essere utilizzato come sciacquo orale all'1%, o per applicazione diretta sulle zone sospette, in soluzione acquosa neutra o in soluzione acida debole.
La procedura di colorazione con il Blu di Toluidina segue questi passaggi:
- Sciacquo con Acido Acetico all'1%: Questo primo passaggio prevede l'utilizzo della soluzione per la "pulizia" della sede da residui proteici con una soluzione di acido acetico all'1%.
- Applicazione del Blu di Toluidina all'1%: La sede mucosa viene poi trattata con una soluzione al 1% di Blu di Toluidina per circa 30 secondi. Questo consente al colorante di legarsi al DNA e all'RNA presenti nel tessuto.
- Risciacquo con Acqua: Successivamente, il campione viene risciacquato con acqua per rimuovere l'eccesso di colorante.
- Tamponamento con Acido Acetico all'1%: Infine, si effettua un ulteriore trattamento con acido acetico all'1% per ridurre il livello di colorazione di fondo. Questo passaggio aiuta a migliorare il contrasto e la nitidezza dell'immagine.
Nonostante la sua semplicità e il basso costo economico, purtroppo gli studi evidenziano valori difformi di sensibilità e specificità per la individuazione di displasia e carcinoma orale, rendendo limitato il valore predittivo di questa tecnica. Si rivela tuttavia utile per i clinici per la scelta dei siti da sottoporre a biopsia incisionale all'interno di ampie lesioni sospette. La capacità del Blu di Toluidina di legarsi selettivamente ad aree con alta concentrazione di acidi nucleici lo rende uno degli strumenti disponibili per evidenziare aree sospette di tessuto neoplastico o pretumorale (Figura 2).
Lumenoscopia
Un’ulteriore tecnica utilizzata per migliorare la discriminazione visuale nella individuazione di aree di lesioni sospette è la lumenoscopia a riflettenza (ViziLite®, Microlux/DL®).
Questo metodo consiste nel trattamento superficiale della mucosa orale con acido acetico diluito all'1% ed esame con luce bianco-azzurra (tra 430 e 580 nm) per valutare una particolare chemioluminescenza, la cosiddetta colorazione "acetowhite".
Durante l'esame, la mucosa normale appare di un colorito bluastro, mentre l'epitelio anormale diventa visibile come area biancastra, con le lesioni come le leucoplachie orali delineate con accentuazione del colore bianco e dei bordi (Figura 3).
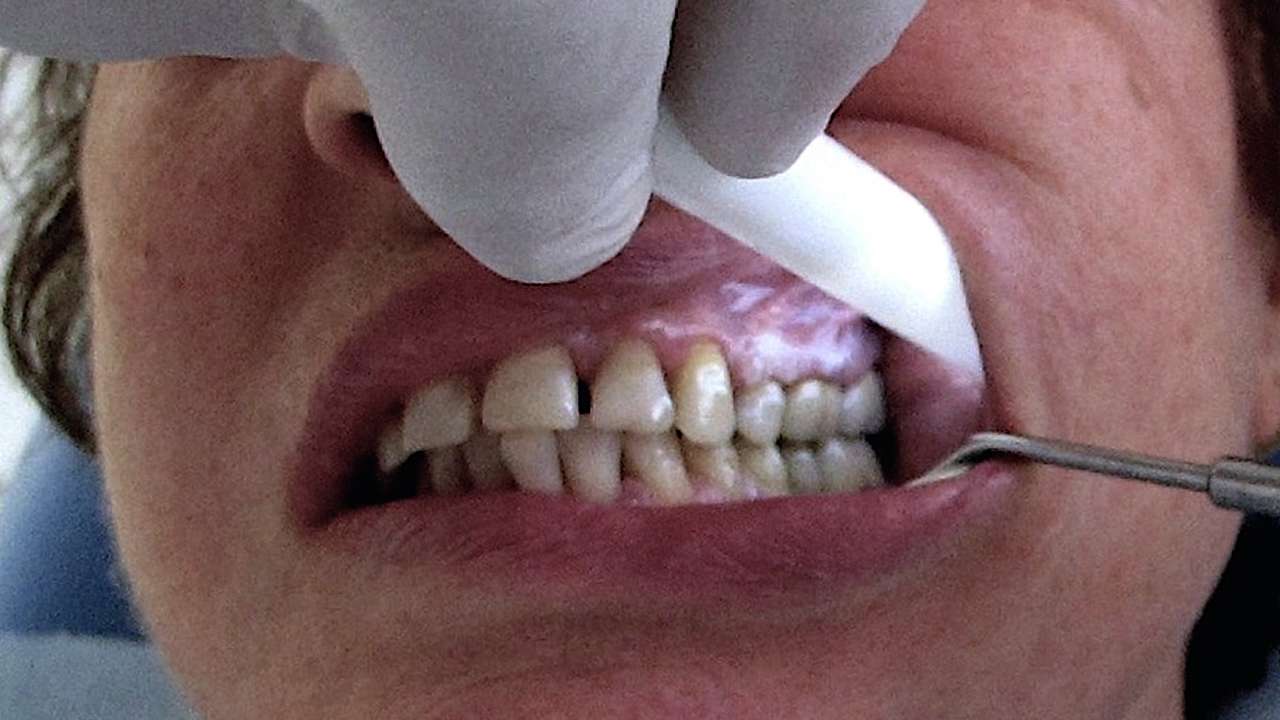
La lumenoscopia ha un limite significativo: non riesce a distinguere tra diverse condizioni patologiche come iperplasia epiteliale, displasia, carcinoma e infiammazioni. Questo rappresenta un evidente svantaggio per l'uso di questa tecnica come strumento diagnostico affidabile.
La sensibilità della lumenoscopia è stata stimata attorno allo 0,77, il che indica che ha una buona capacità di identificare correttamente i pazienti affetti da cancro orale. D'altra parte, la specificità è solo dello 0,28, suggerendo che la tecnica presenta una notevole limitazione nell'escludere i pazienti non affetti da cancro orale, portando a un numero elevato di falsi positivi. Sebbene la lumenoscopia migliori la visualizzazione delle lesioni bianche, la sua utilità rimane limitata e le prove scientifiche non supportano il suo impiego routinario nella pratica clinica, né generale né specialistica.
Diversi studi hanno tuttavia dimostrato che la luce bianca a lunghezza d'onda corta è più utile delle luci operatorie a incandescenza per la rilevazione del carcinoma squamocellulare orale (OSCC) e delle lesioni potenzialmente maligne della mucosa orale (OPML).
In sintesi, mentre la lumenoscopia rappresenta un interessante sviluppo tecnologico nel campo della diagnostica orale, la sua efficacia è limitata dalla bassa specificità e dalla difficoltà di distinguere tra vari tipi di anomalie epiteliali.
Imaging a banda stretta (NBI, narrow band imaging®)
L'imaging c.d. "a banda stretta" o NBI (Narrow Band Imaging®) tramite l'illuminazione con lunghezze d'onda coerenti multiple e loro filtratura digitale consente la discriminazione delle aree di mucosa anormali.
La tecnica NBI consente la visualizzazione del pattern della rete capillare superficiale e dello strato sottomucoso, sfruttando le proprietà cromatofore dell’emoglobina presente all’interno dei vasi. La tecnica consente la valutazione accurata del pattern microvascolare delle anse capillari intrapapillari (IPCL, intra-papillary capillary loops) e della sua morfologia normale o con alterazioni caratteristiche delle aree di tessuto tumorale o pretumorale e quindi aiutare nella diagnosi.
Lo strumento è un apparecchio con una fonte luminosa ad alta intensità con separazione e filtrazione a banda stretta dei fasci illuminanti, suddivisi in una luce blu (415nm) che corrisponde al picco di Soret di assorbimento dell’emoglobina, e una luce verde (540nm). I fasci luminosi vengono convogliati mediante una fibra ottica e l'immagine della mucosa che formano viene rilevata mediante una telecamera, e sottoposta ad analisi computerizzata, quindi visualizzata su un monitor.
L’imaging a lunghezza d’onda blu consente la visualizzazione di una vascolarizzazione superficiale mentre la luce a lunghezza d’onda verde rivela vasi più profondi e di diametro maggiore.
Nel tessuto orale normale è presente una stretta interazione tra le papille connettivali e le creste epiteliali (rete pegs) che vanno a formare delle anse uniformi. In un tessuto neoplastico si può perdere questa caratteristica con una conseguente alterazione nella disposizione microvascolare. Nei tumori delle mucose ad uno stadio più avanzato l’elevato tasso di crescita dei capillari può essere visualizzato tramite tecnica NBI come aree ipercromatiche (Figura 4).
Fondamentalmente sono tre le caratteristiche visibili mediante luce NBI che differenziano un tessuto sano da uno displasico: 1- modifica della vascolarizzazione data dalla neoangiogenesi tumorale; 2 - distruzione vascolare data da una proliferazione incontrollata; 3 - spostamento del sistema vascolare esistente che porta ad un pattern irregolare dei vasi. Un’immagine NBI di displasia ad alto grado o di cancro orale mostra un aumento del numero di vasi con morfologia alterata.
L’NBI è una metodica di imaging endoscopica sicura e non invasiva per il paziente, fornisce al clinico immagini chiare per un processo decisionale terapeutico semplificato.
A parte i costi elevati dell'apparecchiatura proprietaria Olympus®, per i consueti setting professionali odontoiatrici, la sua applicazione è più utile per la individuazione di aree di lesione nei visceri cavi a superficie umida, come faringe, laringe, esofago o a livello vaginale; inoltre le ottiche di proiezione e rilevamento attualmente esistenti per la tecnica NBI sono ancora poco adatte all'impiego nel cavo orale, per le caratteristiche di focalizzazione e profondità di campo; la tecnica pur fornendo ottimi risultati risulta attualmente più adatta all'otorinolaringoiatria, alla gastroenterologia e alla ginecologia e urologia.
La sua applicazione in queste discipline risulta molto utile anche per la definizione dei margini chirurgici durante interventi di resezione, al fine di ridurre al minimo la morbilità e una maggior preservazione possibile del tessuto sano.
Autofluorescenza tissutale
Tra i metodi per migliorare l'imaging ottico delle mucose e evidenziare lesioni orali e tessuto maligno vi è la tecnica di rilevamento dell'autofluorescenza propria della mucosa orale o imaging ottico a fluorescenza (OFI).
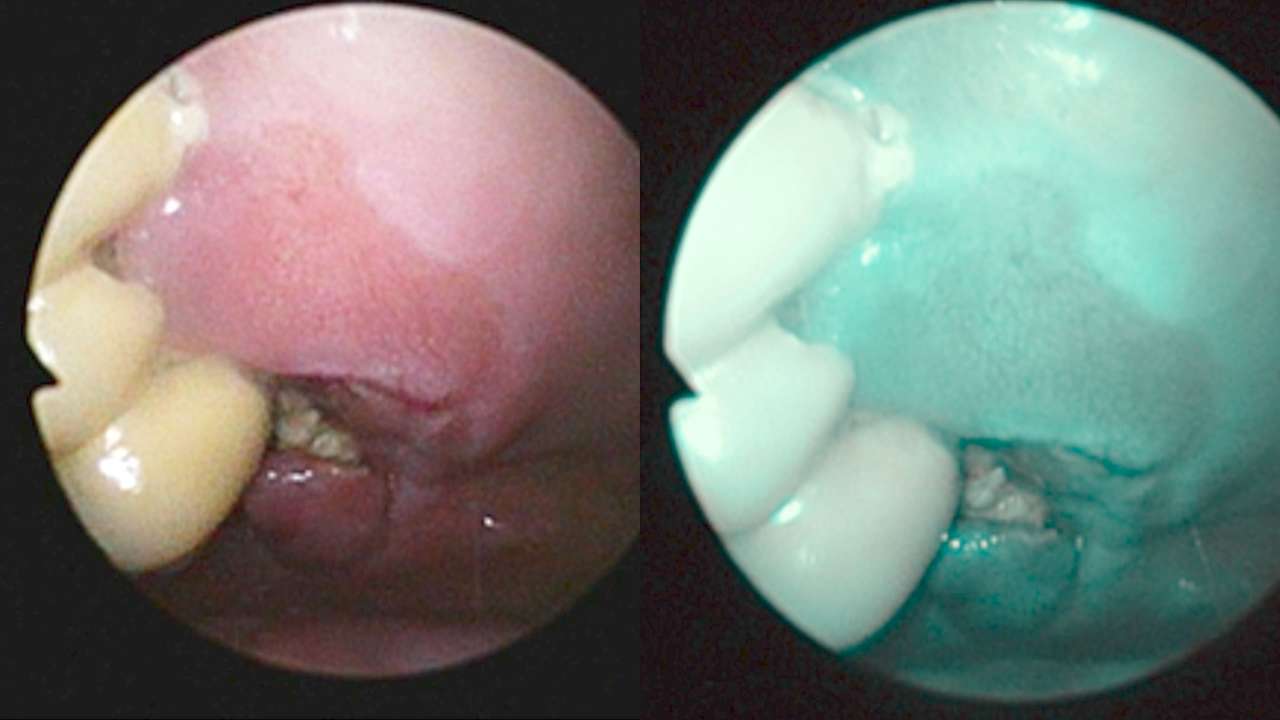
Mediante questa tecnica viene sfruttata la capacità derivante da cromatofori endogeni, alcune molecole, cosiddette fluorofori, presenti all’interno delle cellule e dei tessuti, di emettere una radiazione luminosa fluorescente quando vengono colpiti da luce di una specifica lunghezza d’onda. Quando un tessuto viene illuminato con luce a lunghezza d’onda corta, ad esempio luce blu, molecole presenti nelle cellule epiteliali e nel connettivo si eccitano ed emettono luce a lunghezza d’onda maggiore, rilevabile mediante specifici dispositivi. È importante dunque sottolineare che, mentre le cellule normali emettono luce verde, cellule anormali, come quelle che costituiscono un tessuto tumorale o pretumorale, non emettono luce, dando quindi una perdita di fluorescenza.
I principali fluorofori epiteliali che contribuiscono all’autofluorescenza normale sono nicotinammide adenina dinucleotide (NADH) e flavina adenina dinucleotide (FAD), e collagene ed elastina, fluorofori della tonaca propria connettivale, capaci di fluorescenza di tonalità verde-giallastra se eccitati da una radiazione luminosa di lunghezza d'onda nell’intervallo compreso tra 400-460nm. L’emoglobina invece assorbe la luce eccitante, per la presenza nella sua composizione del gruppo eme, provocando dunque in aree ad alta concentrazione una perdita di autofluorescenza della mucosa. Altri fattori che contribuiscono sono aumento del metabolismo, aumento dell'area nucleare e pleomorfismo, aumento dello spessore epiteliale, aumento della vascolarizzazione, scomposizione dei legami incrociati del collagene, e produzione di fluorofori da parte di batteri.
L'impiego clinico della tecnica si basa sul concetto che displasia e cancro causano cambiamenti evidenti nell'autofluorescenza intrinseca della mucosa orale. Il carcinoma orale, anche in stadio precoce, è spesso associato a una perdita di visualizzazione della fluorescenza (FVL, fluorescence visualization loss) indotto dalla diminuzione dell'autofluorescenza tissutale intrinseca, che può essere utilizzata per facilitare l'individuazione di lesioni e la selezione delle porzioni di tessuto per la biopsia. La displasia e il cancro causano in genere una grande perdita di autofluorescenza verde, insieme a un piccolo aumento dell'autofluorescenza rossa (Figure 5-6).
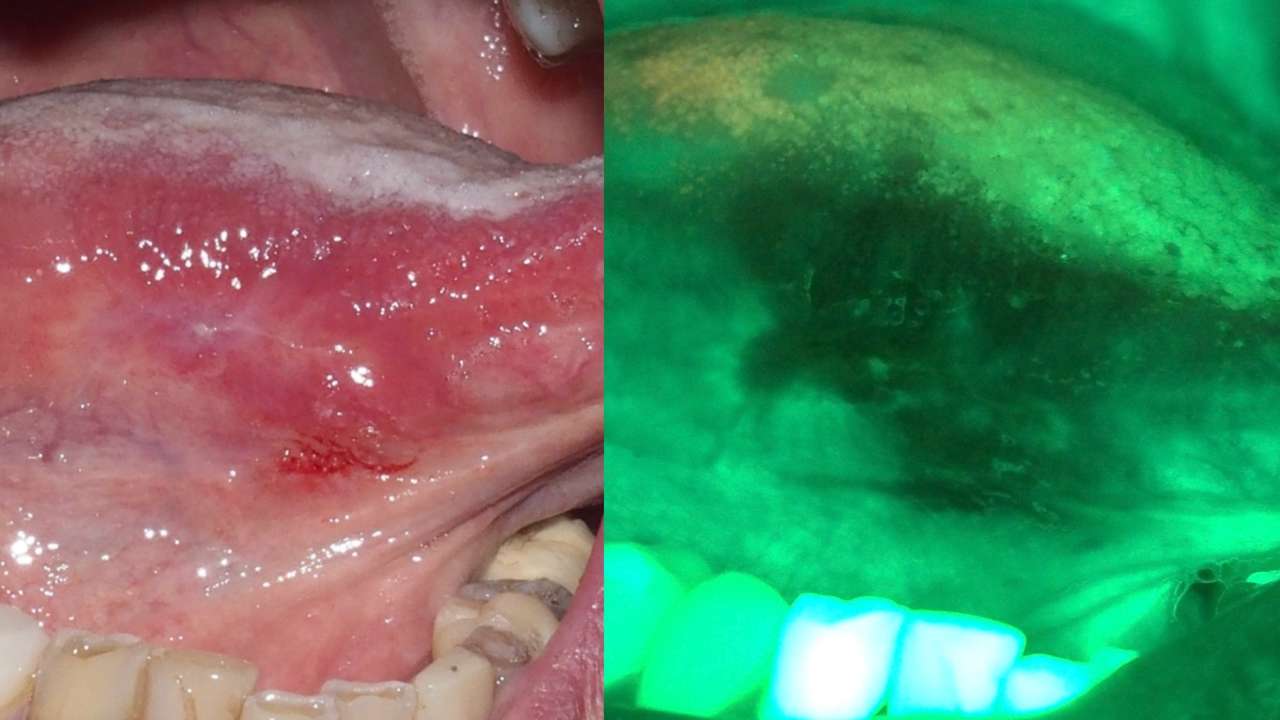
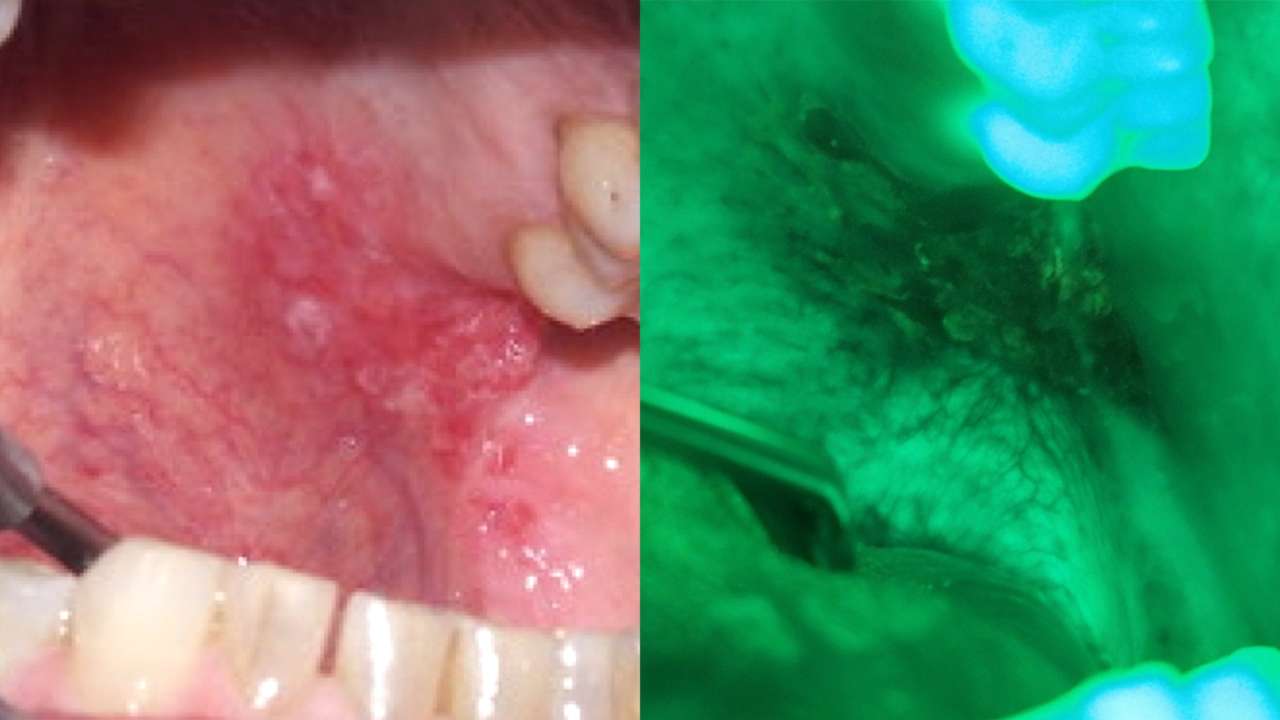
Diversi studi scientifici sono stati condotti e sono in corso per l'applicazione della valutazione dell'autofluorescenza tissutale della mucosa orale con metodi spettroscopici digitali che impiegano appositi algoritmi per valutare i rapporti tra fluorescenza verde e rossa, con possibilità di arrivare a diagnosi corrette in oltre il 95% dei casi.
Gli studi che hanno valutato l'efficacia del rilevamento dell'autofluorescenza nella pratica clinica hanno evidenziato valori di sensibilità da media ad alta ma bassa specificità dovuta alla presenza di falsi positivi dovuti a lesioni infiammatorie della mucosa orale.
In presenza di lesioni infiammatorie della mucosa orale con l'impiego dell'autofluorescenza tissutale si possono riscontrare dei falsi positivi, principalmente dovuti all’elevato flusso sanguigno e alla concentrazione di emoglobina, con una perdita di fluorescenza.
I dispositivi commercializzati sono di varia sofisticazione tecnologica e semplicità di uso, e alcuni consentono in modo diretto o indiretto il rilevamento fotografico del risultato del loro utilizzo nel cavo orale (VelScope®, Identafi®, Bio/Screen®, SapphireR Plus LD®, DentLight DOE®, OralID®, Lasotronix Diagnostic®, Goccles® Pierrel).
Conclusioni
Le tecniche e i metodi di ausilio ottico possono assistere il clinico nell'individuazione di lesioni del cavo orale difficili da evidenziare o occulte, a scopo di screening periodico delle mucose orali o come aiuto nella valutazione di casi clinici sintomatici. Con alcune tecniche l’individuazione delle lesioni maligne e potenzialmente maligne può venire semplificata, anche se nessuna tecnica ha evidenziato prove scientifiche definitive di sensibilità e specificità superiori all'esame clinico orale convenzionale.
Il rilevamento dell'autofluorescenza tissutale e la colorazione con blu toluidina sono procedure semplici, economiche, rapide e non invasive; tuttavia, l'interpretazione del risultato è strettamente correlata all'esperienza e alle conoscenze dell'operatore. I metodi sono in grado di identificare le lesioni sospette ma non sono in grado di distinguere tra lesioni benigne e maligne; per questo motivo devono sempre essere confrontati con l'esame istopatologico.
Queste procedure possono aiutare l'odontoiatra e l'igienista dentale a migliorare l'individuazione di aree di lesione della mucosa orale e incoraggiano i sanitari a eseguire un esame più accurato del cavo orale, in modo da poter anticipare il riscontro e la diagnosi corretta del carcinoma orale e delle lesioni premaligne.
Warnakulasuriya KA, Johnson NW. Sensitivity and specificity of OraScan (R) toluidine blue mouthrinse in the detection of oral cancer and precancer. J Oral Pathol Med. 1996 Mar;25(3):97-103.
Lingen MW, Kalmar JR, Karrison T, Speight PM. Critical evaluation of diagnostic aids for the detection of oral cancer. Oral Oncol. 2008;44:10–22
Farah CS, McCullough MJ. A pilot case control study on the efficacy of acetic acid wash and chemiluminescent illumination (ViziLite) in the visualisation of oral mucosal white lesions. Oral Oncol. 2007 Sep;43(8):820-4.
Patton L, Epstein J, Kerr A. Adjunctive techniques for oral cancer examination and lesion diagnosis: a systematic review of the literature. J Am Dent Assoc. 2008;139:896–905
A’Amar O, Liou L, Rodriguez-Diaz E, De las Morenas A, Bigio I. Comparison of elastic scattering spectroscopy with histology in ex vivo prostate glands: potential application for optically guided biopsy and directed treatment. Lasers Med Sci. 2013;28:1323–9
Awan KH, Patil S. Efficacy of Auto- fluorescence Imaging as an Adjunctive Technique for Examination and Detection of Oral Potentially Malignant Disorders: A Systematic Review. J Contemp Dent Pract 2015;16(9):744-749.
Tipirneni KE, Rosenthal EL, Moore LS, Haskins AD, Udayakumar N, Jani AH, Carroll WR, Morlandt AB, Bogyo M, Rao J, Warram JM. Fluorescence Imaging for Cancer Screening and Surveillance. Mol Imaging Biol. 2017 Oct;19(5):645-655.
van Keulen S, van den Berg NS, Nishio N, Birkeland A, Zhou Q, Lu G, Wang HW, Middendorf L, Forouzanfar T, Martin BA, Colevas AD, Rosenthal EL. Rapid, non-invasive fluorescence margin assessment: Optical specimen mapping in oral squamous cell carcinoma. Oral Oncol. 2019 Jan;88:58-65.
Giovannacci I, Magnoni C, Vescovi P, Painelli A, Tarentini E, Meleti M. Which are the main fluorophores in skin and oral mucosa? A review with emphasis on clinical applications of tissue autofluorescence. Arch Oral Biol. 2019 Sep;105:89-98.
Simonato LE, Tomo S, Scarparo Navarro R, Balbin Villaverde AGJ. Fluorescence visualization improves the detection of oral, potentially malignant, disorders in population screening. Photodiagnosis Photodyn Ther. 2019 Sep;27:74-78.
Abati S, Bramati C, Bondi S, Lissoni A, Trimarchi M. Oral Cancer and Precancer: A Narrative Review on the Relevance of Early Diagnosis. Int J Environ Res Public Health. 2020 Dec 8;17(24):9160.
Warnakulasuriya S, Kerr AR. Oral Cancer Screening: Past, Present, and Future. J Dent Res. 2021 Nov;100(12):1313-1320.
Vonk J, de Wit JG, Voskuil FJ, Witjes MJH. Improving oral cavity cancer diagnosis and treatment with fluorescence molecular imaging. Oral Dis. 2021 Jan;27(1):21-26.
Lajolo C, Tranfa M, Patini R, Fiorino A, Musarra T, Boniello R, Moro A. Clinical Evaluation of the Optical Filter for Autofluorescence Glasses for Oral Cancer Curing Light Exposed (GOCCLES®) in the Management of Potentially Premalignant Disorders: A Retrospective Study. Int J Environ Res Public Health. 2022 May 4;19(9):5579.





